🛑 DNA
DNA
- DNA birbiri çevresinde sarmal oluşturan iki polinükleotid zincirden yapılıdır.
- Polisakkarid, protein ve lipidlerin yanısıra, polinükleotidler dört büyük makromolekül tipinden biridir.
- DNA nükleotidlerden oluşur.
- Her nükleotid bir bazdan (sitozin (C), guanin (G), adenin (A) ya da thimin (T)), bir şekerden (deoxyriboz) ve bir fosfat grubundan oluşur.
- Nükleotidler birbirine kovalent bağlar ile bağlıdır (fosfo-diester bağ).
- Bağ bir nükleotidin şekeri ve ötekinin fosfatı arasındadır.
- Bağ DNA için değişimli fosfat—şeker—fosfat—şeker— … yapısından oluşan bir omurga sağlar.
- İki ayrı polinükleotid zincirin azot bazları A T ile ve C G ile olmak üzere hidrojen bağları ile bağlanarak çift-zincirli DNAyı oluşturur.
- DNAnın her iki zinciri de biolojik programı (genetik bilgi) depolar.
- İki zincir ayrılırken bilgiler eşlemlenir.
- DNAnın büyük bölümü (insanda %98) kod barındırmaz (protein sentezi için kalıp sağlamaz).
- Çifte zincirden her biri ötekine anti-paralel uzanır.
- Her bir şekere dört nükleobaz tipinden biri bağlanır.
- Bu nükleobazlar dizisi genetik bilgiyi kodlayan yapıdır.
- Ökaryotik hücrelerde DNA kromozomlar denilen uzun yapılara örgütlenir.
- Tipik hücre bölünmesinden önce, DNA eşlemleme sürecinde kromozamlar eşlenir.
- Kromozom I 220 milyon baz çifti (85 mm) ile en uzun insan kromozomudur.
|
|

|
|
|
🛑 DNA YAPISI
Storage and Expression of Genetic Information
Lippincott’s Illustrated Reviews: Biochemistry, Fifth Edition
DNA Structure |
| |
 |
| |
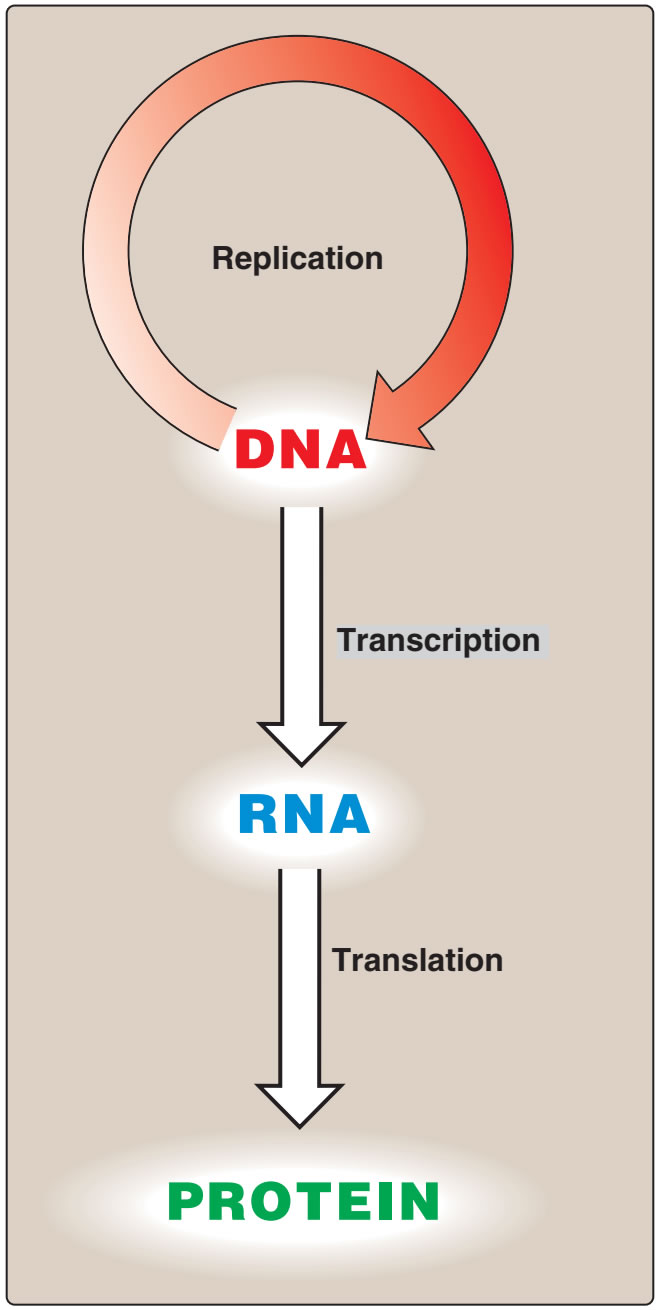
Figür 29.1
Moleküler biolojinin “özeksel dogması.” |
Figure 29.1
The “central dogma” of molecular biology. |
|
| |
|
|
| Bilginin DNAdan RNAya ve ondan proteine akışına moleküler biolojinin ‘özeksel dogması” denir (Figür 29.1), ve tüm örgenlikler için betimleyicidir (genetik bilgileri için depo olarak RNA taşıyan kimi virüslerin dışlanması ile). |
The flow of information from DNA to RNA to protein is termed the “central dogma” of
molecular biology (Figure 29.1), and is descriptive of all organisms, with the exception of some
viruses that have RNA as the repository of their
genetic information.
|
|
|
|
I. GENEL BAKIŞ
Nükleik asitler genetik bilginin depolanması ve anlatımı için gereklidir. Kimyasal olarak ayrı iki nükleik asit tipi vardır: Deoksiribonükleik asit (DNA) ve ribonükleik asit (RNA). DNA genetik bilginin deposudur ve yalnızca ökaryotik örgenliklerin çekirdeklerindeki kromozomlarda değil, ama bitkilerin mitokondri ve kloroplastlarında da bulunur. Çekirdekten yoksun prokaryotik hücrelerin tek bir kromozomları vardır, ama plasmidler biçiminde kromozomal-olmayan DNA da kapsayabilirler. DNAda bulunan genetik bilgi DNA eşlemesi yoluyla eşlemlenerek yeni hücrelere iletilir. Döllenmiş bir yumurtada kapsanan DNA bir örgenliğin gelişimini yöneten bilgiyi kodlandırır. Bu gelişme milyarlarca hücrenin üretimine götürebilir. Her bir hücre özelleşmiştir ve yalnızca örgenliği sürdürmede rolünü yerine getirmesi için gerekli olan işlevleri anlatabilir. Buna göre, DNA bir hücrenin bölündüğü her keresinde tam eşleme yapabilmekle kalmamalı, ama kapsadığı bilginin seçici olarak anlatılmasını da sağlamalıdır. RNA eşlemlemesi (transcription) genetik bilginin anlatımında ilk evredir. Sonra, iletmen RNAnın nükleotid dizisinde kapsanan kod çevrilir (protein bireşimi), böylece genetik anlatımı tamamlanır. |
|
|
I. OVERVIEW
Nucleic acids are required for the storage and expression of genetic
information. There are two chemically distinct types of nucleic acids:
deoxyribonucleic acid (DNA) and ribonucleic acid (RNA). DNA, the repository of genetic information, is present not only in
chromosomes in the nucleus of eukaryotic organisms, but also in
mitochondria and the chloroplasts of plants. Prokaryotic cells, which
lack nuclei, have a single chromosome, but may also contain
nonchromosomal DNA in the form of plasmids. The genetic information found in DNA is copied and transmitted to daughter cells through
DNA replication. The DNA contained in a fertilized egg encodes the
information that directs the development of an organism. This development may involve the production of billions of cells. Each cell is
specialized, expressing only those functions that are required for it to
perform its role in maintaining the organism. Therefore, DNA must be
able to not only replicate precisely each time a cell divides, but also
to have the information that it contains be selectively expressed.
Transcription (RNA synthesis) is the first stage in the expression of
genetic information (see Chapter 30). Next, the code contained in the
nucleotide sequence of messenger RNA molecules is translated
(protein synthesis), thus completing gene expression. |
|
|
| |
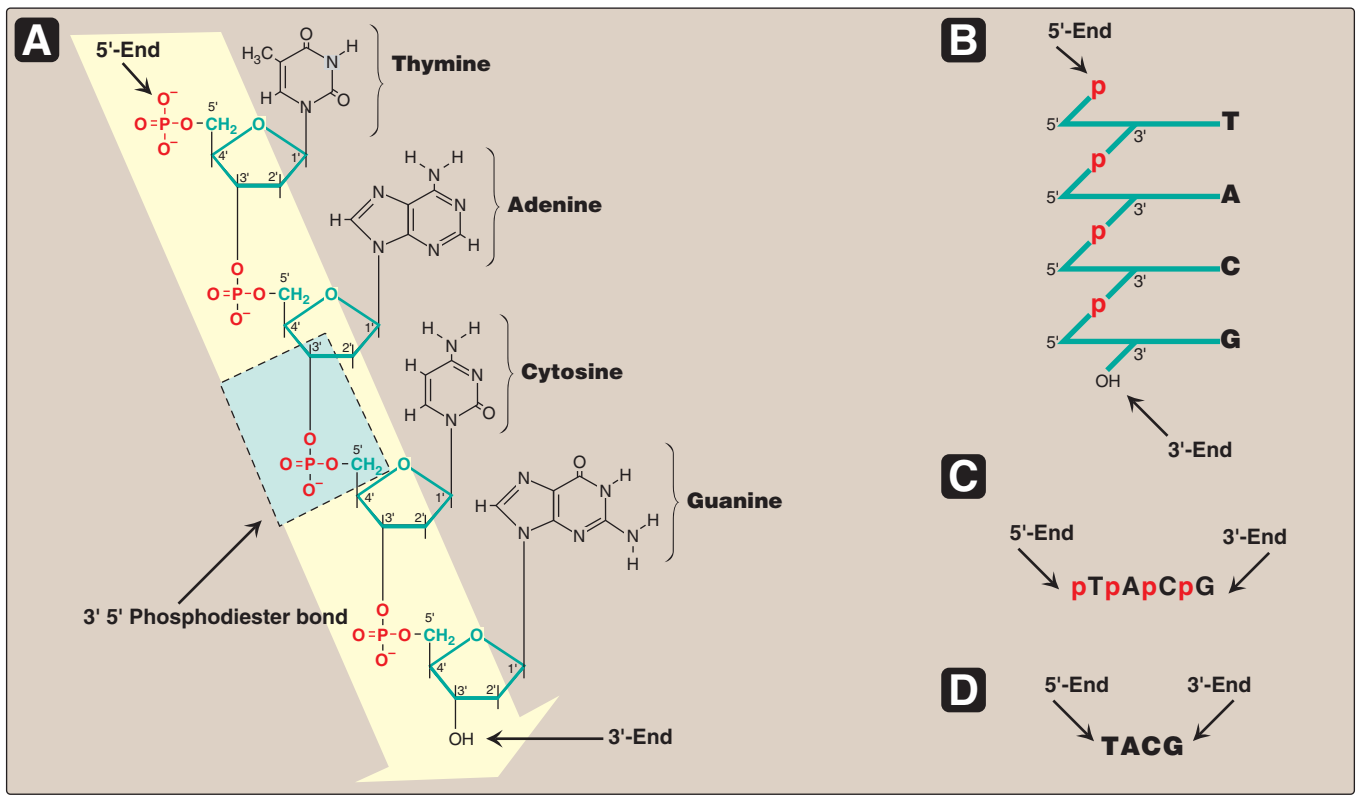
Figür 29.2
A. 5'→ 3' yönünde yazılı olarak gösterilen nükleotid dizisi ile DNA zinciri. Bir 3' →5'-fosfodiester
bağı mavi kutuda gösterilmiş, ve deoksiriboz-fosfat omurgası sarı renkli alandadır.
B. Daha stilize biçimde yazılı DNA zinciri riboz-fosfat omurgayı öne çıkarmaktadır.
C. Nükleotid dizisinin daha yalın bir temsili.
D. En yalın (ve en yaygın) temsilde bazlar için kısaltmalar uylaşımsal
5'→3' yönünde yazılmıştır. |
|
|
Figure 29.2
A. DNA chain with the nucleotide sequence shown written in the 5'→ 3' direction. A 3' →5'-phosphodiester
bond is shown highlighted in the blue box, and the deoxyribose-phosphate backbone is shaded in yellow.
B. The DNA chain written in a more stylized form, emphasizing the ribose–phosphate backbone.
C. A simpler representation of the nucleotide sequence.
D. The simplest (and most common) representation,
with the abbreviations for the bases written in the conventional 5'→3' direction. |
|
|
|
| |
II. DNA YAPISI
DNA 3'→5'–fosfodiester bağları ile kovalent tarzında bağlanmış bir deoksiribonükleosid monofosfat polimeridir. Tekil-telli (ss: single-stranded) DN kapsayan birkaç virüs dışında, DNA çift-telli (ds: double-stranded) molekül olarak bulunur ve yapısındaki iki tel birbiri çevresine dolanarak bir çifte sarmal oluşturur. Ökaryotik hücrelerde, DNA nükleusta bulunan çeşitli protein tipleri (ortak bir adlandırma ile nükleoprotein olarak bilinirler) ile bağlantı içinde bulunur. Prokaryotlarda ise protein-DNA karmaşası nükleoid olarak bilinen bir membran-bağlantısız bir bölgede bulunur. |
|
|
II. STRUCTURE OF DNA
DNA is a polymer of deoxyribonucleoside monophosphates covalently
linked by 3'→5'–phosphodiester bonds. With the exception of a few
viruses that contain single-stranded (ss) DNA, DNA exists as a doublestranded (ds) molecule, in which the two strands wind around each
other, forming a double helix. In eukaryotic cells, DNA is found associated with various types of proteins (known collectively as nucleoprotein)
present in the nucleus, whereas in prokaryotes, the protein–DNA complex is present in a nonmembrane-bound region known as the nucleoid. |
|
A. 3'→5'-Fosfodiester bağları
Fosfodiester bağları bir nükleotidin deoksipentozunun 3'-hidroksil grubunu bir fosfat grubu yoluyla bitişik nükleotidin deoksipentozunun 5'-hidroksil grubu ile birleştirir (Figür 29.2). Sonuçta ortaya çıkan uzun, dalsız zincir kutupsallık gösterir ve başka nükleotidlere bağlanmış olmayan bir 5'-uç (serbest fosfatlı) ve bir de 3'-uç (serbest hidroksilli) taşır. Ortaya çıkan deoksiriboz-fosfat omurgası boyunca yerleşen bazlar uylaşımsal olarak her zaman zincirin 5'-ucundan 3'-ucuna doğru dizili olarak yazılır. Örneğin Figür 29.2'de gösterilen DNAdaki bazlar dizisi "thimin, adenin, sitozin, guanin" olarak okunur (5'-TACG-3'). Nükleotidler (DNA ya da RNAdaki) arasındaki fosfodiester bağlantılar kimyasallar tarafından hidrolitik olarak yarılabilir, ya da bir nükleazlar ailesi tarafından enzimatik olarak hidrolize edilebilir: DNA için deoksiribonükleazlar ve RNA için ribonükleazlar. [Not: Yalnızca RNA alkali tarafından yarılır.] |
|
|
A. 3'→5'-Phosphodiester bonds
Phosphodiester bonds join the 3'-hydroxyl group of the deoxypentose
of one nucleotide to the 5'-hydroxyl group of the deoxypentose of an
adjacent nucleotide through a phosphate group (Figure 29.2). The
resulting long, unbranched chain has polarity, with both a 5'-end (the
end with the free phosphate) and a 3'-end (the end with the free
hydroxyl) that are not attached to other nucleotides. The bases
located along the resulting deoxyribose–phosphate backbone are, by
convention, always written in sequence from the 5'-end of the chain
to the 3'-end. For example, the sequence of bases in the DNA shown in Figure 29.2 is read “thymine, adenine, cytosine, guanine”
(5'-TACG-3'). Phosphodiester linkages between nucleotides (in DNA
or RNA) can be cleaved hydrolytically by chemicals, or hydrolyzed
enzymatically by a family of nucleases: deoxyribonucleases for DNA
and ribonucleases for RNA. [Note: Only RNA is cleaved by alkali.] |
|
|
| |
 |
| |
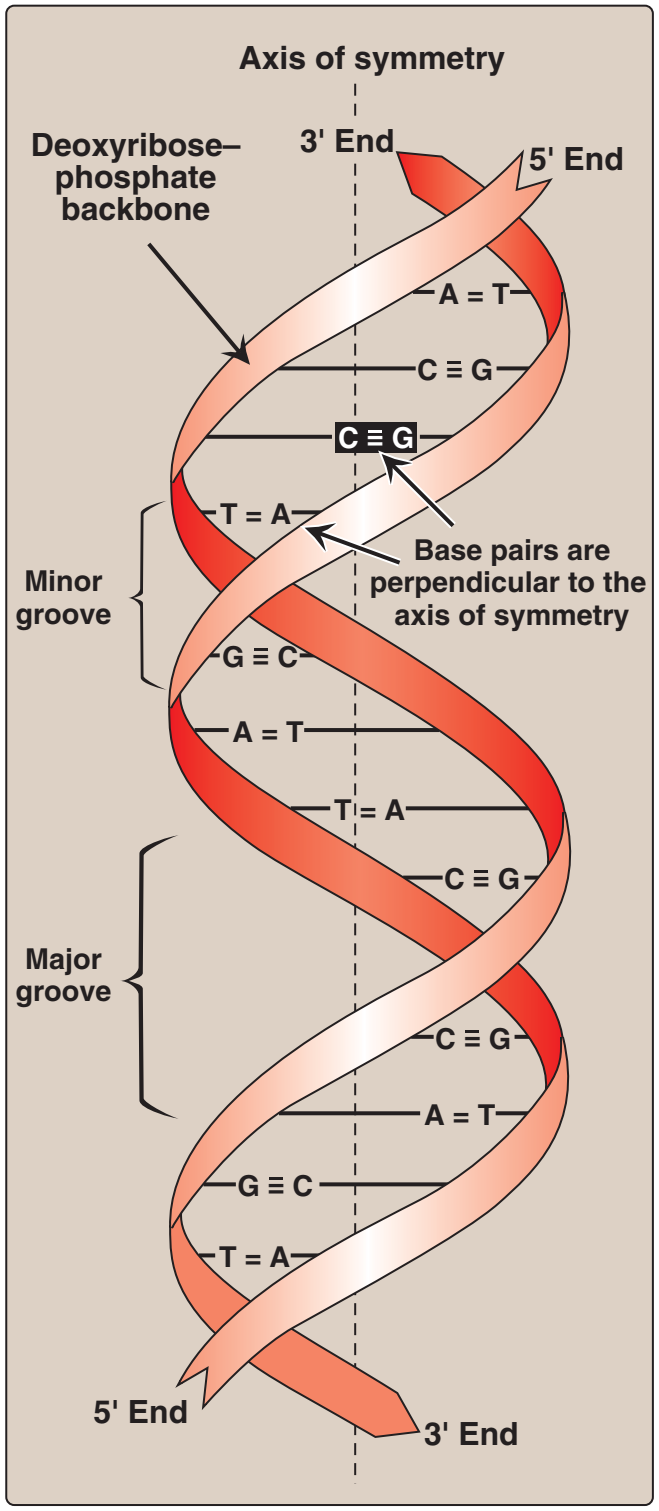
Figür 29.3
DNA çifte sarmalı ve kimi önemli yapısal özellikleri. |
Figure 29.3
DNA double helix, illustrating some
of its major structural features.
|
|
|
| |
|
|
B. Çifte sarmal
Çifte sarmalda iki zincir simetri ekseni denilen ortak bir eksen çevresinde sarımlanır. Zincirler antiparalel bir tarzda eşlenir ve buna göre bir telin 5'-ucu ötekin telin 3'-teli ile eşlenir (Figür 29.3). DNA sarmalında her bir zincirin hidrofilik deoksiriboz-fosfat omurgası molekülün dışında iken, hidrofobik bazlar içeride yığılmıştır. Bütününde yapı bükülmüş bir merdiveni andırır. Sarmaldaki iki tel arasındaki uzaysal ilişki bir büyük (geniş) ve bir de küçük (dar) oluk yaratır. Bu oluklar düzenleyici proteinlerin DNZ zinciri boyunca özgül tanıma dizilerine bağlanması için giriş sağlar. Belli anti-kanser ilaçları, örneğin daktinomisin (aktinomisin D), sitotoksik etkilerini DNA çifte sarmalarının dar oluğuna girerek ve böylece DNA ve RNA bireşimine engel olarak uygular. |
|
|
B. Double helix
In the double helix, the two chains are coiled around a common axis
called the axis of symmetry. The chains are paired in an antiparallel
manner, that is, the 5'-end of one strand is paired with the 3'-end of
the other strand (Figure 29.3). In the DNA helix, the hydrophilic
deoxyribose–phosphate backbone of each chain is on the outside of
the molecule, whereas the hydrophobic bases are stacked inside.
The overall structure resembles a twisted ladder. The spatial relationship between the two strands in the helix creates a major (wide)
groove and a minor (narrow) groove. These grooves provide access
for the binding of regulatory proteins to their specific recognition
sequences along the DNA chain. Certain anticancer drugs, such as
dactinomycin (actinomycin D), exert their cytotoxic effect by intercalating into the narrow groove of the DNA double helix, thus interfering with DNA and RNA synthesis. |
|
|
| |
 |
| |
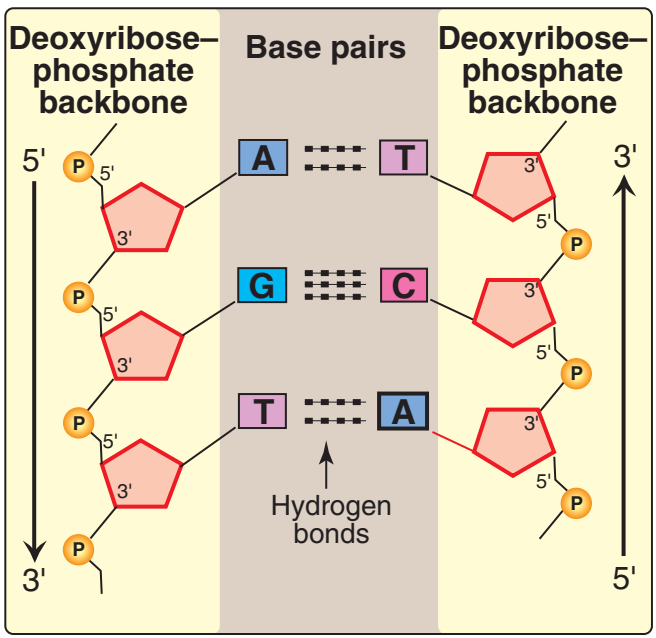
Figür 29.4
İki tümleyici DNA dizisi. |
Figure 29.4
Two complementary DNA
sequences.
|
|
|
|
|
|
| |
|
|
|
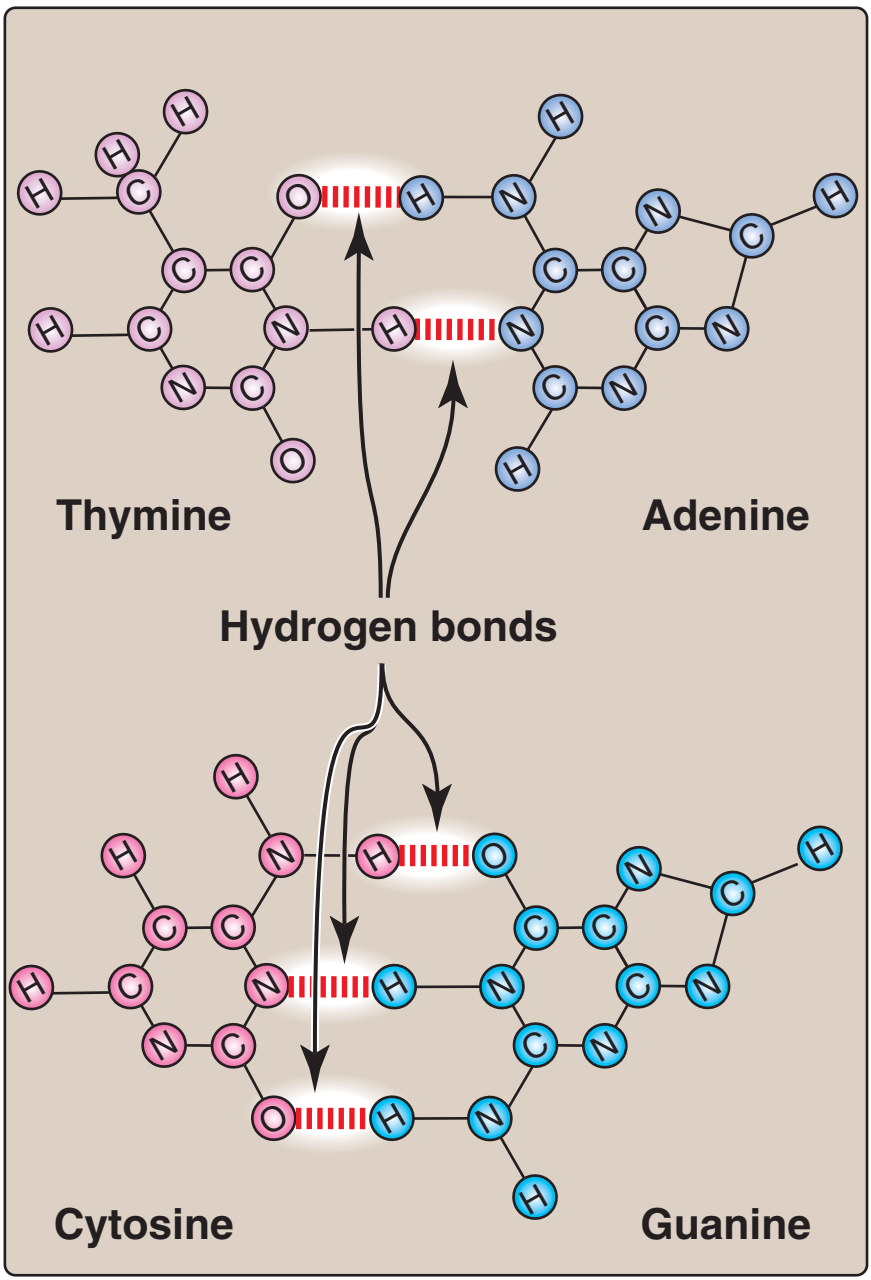
1. Baz eşlenmesi: Bir DNA telinin bazları ikinci telin bazları ile eşlenir, öyle bir yolda ki bir adenin her zaman bir thimin ve bir sitozin her zaman bir guanin ile eşlenmir. [Not: Baz çiftleri sarmalın eksenine diktir (bkz. Figür 29.3).] Buna göre, DNA çifte sarmalının bir polinükleotid zinciri her zaman ötekinin bileşenidir. Bir zincirdeki bazlar dizisi verildiğinde, tümleyici zincirdeki bazlar dizisi belirlenebilir (Figür 29.4). [Not: DNAdaki özgül baz eşlenmesi Chargaff Kuralına götürür: Herhangi bir dsDNA örneğinde, adenin miktarı thimin miktarına, guanin miktarı sitozin miktarına eşittir, ve total pürin miktarı total pirimidin miktarına eşittir.] Baz çiftleri hidrojen bağları ile birarada tutulur: A ve T arasında iki ve G ve C arasında üç (Figür 29.5). Bu hidrojen bağları, artı yığılı bazlar arasındaki hidrofobik etkileşimler, çifte sarmalın yapısını kararlı kılar. |
|
|
1. Base pairing: The bases of one strand of DNA are paired with the
bases of the second strand, so that an adenine is always paired
with a thymine and a cytosine is always paired with a guanine.
[Note: The base pairs are perpendicular to the axis of the helix
(see Figure 29.3).] Therefore, one polynucleotide chain of the DNA
double helix is always the complement of the other. Given the
sequence of bases on one chain, the sequence of bases on the
complementary chain can be determined (Figure 29.4). [Note: The
specific base pairing in DNA leads to the Chargaff Rule: In any
sample of dsDNA, the amount of adenine equals the amount of
thymine, the amount of guanine equals the amount of cytosine, and
the total amount of purines equals the total amount of pyrimidines.]
The base pairs are held together by hydrogen bonds: two between
A and T and three between G and C (Figure 29.5). These hydrogen
bonds, plus the hydrophobic interactions between the stacked
bases, stabilize the structure of the double helix. |
|
|
| |
 |
| |
Figür 29.5
Tümleyici bazlar arasındaki hidrojen bağları |
Figure 29.5
Hydrogen bonds between
complementary bases.
|
|
|
|
|
 of DNA.png) |
| |
Figür 29.6
Değişik nükleotid bileşimleri olan DNA moleküllerinin erime sıcaklıkları. (260 nm dalgaboyu ile, tekil-telli DNAnın göreli olarak çift-telli DNAdan daha yüksek bir soğrulma oranı vardır.) |
Figure 29.6
Melting temperatures (Tm) of DNA
molecules with different nucleotide
compositions. (At a wavelength of
260 nm, single-stranded DNA has
a higher relative absorbance than
does double-stranded DNA.)
|
|
|
|
| |
|
|
|
| |
| 2. Çifte sarmaldaki iki DNA telinin ayrılması: Çifte sarmalın iki teli eşlenmiş bazlar arasındaki hidrojen bağları bozulunca ayrılır. Bozulma eğer DNA çözeltisinin pHsı değiştirilir ve bu nedenle nükleotid bazlar ionlaşırsa, ya da eğer çözelti ısıtılırsa olabilir. [Not: Fosfodiester bağları bu işlem nedeniyle kopmaz.] DNA ısıtıldığı zaman, sarmal yapının yarısının yitirildiği sıcaklık derecesi ergime sıcaklığı (Tm: melting temperature) olarak tanımlanır. DNAdaki sarmal yapının yitişi (ki buna denaturasion denir) 260 nmde soğrulması ölçülerek gözlenebilir. [Not: ssDNAnın bu dalgaboyunda göreli olarak dsDNAdan daha yüksek bir soğrulma oranı vardır.] G ve C arasında üç ama A ve T arasında yalnızca iki hidrojen bağı olduğu için, daha yüksek A ve T yoğunlukları kapsayan DNA G- ve C-varsıl DNAdan daha düşük bir derecede denaturalize olur (Figür 29.6). Uygun koşullar altında, tümleyici DNA telleri renaturasion (ya da reannealing) denilen süreç yoluyla çifte sarmalı yeniden oluşturabilir. |
|
|
| 2. Separation of the two DNA strands in the double helix: The two
strands of the double helix separate when hydrogen bonds
between the paired bases are disrupted. Disruption can occur in
the laboratory if the pH of the DNA solution is altered so that the
nucleotide bases ionize, or if the solution is heated. [Note:
Phosphodiester bonds are not broken by such treatment.] When
DNA is heated, the temperature at which one half of the helical
structure is lost is defined as the melting temperature (Tm). The
loss of helical structure in DNA, called denaturation, can be monitored by measuring its absorbance at 260 nm. [Note: ssDNA has a
higher relative absorbance at this wavelength than does dsDNA.]
Because there are three hydrogen bonds between G and C but only two between A and T, DNA that contains high concentrations
of A and T denatures at a lower temperature than G- and C-rich
DNA (Figure 29.6). Under appropriate conditions, complementary
DNA strands can reform the double helix by the process called
renaturation (or reannealing). |
|
|
| |
 |
| |
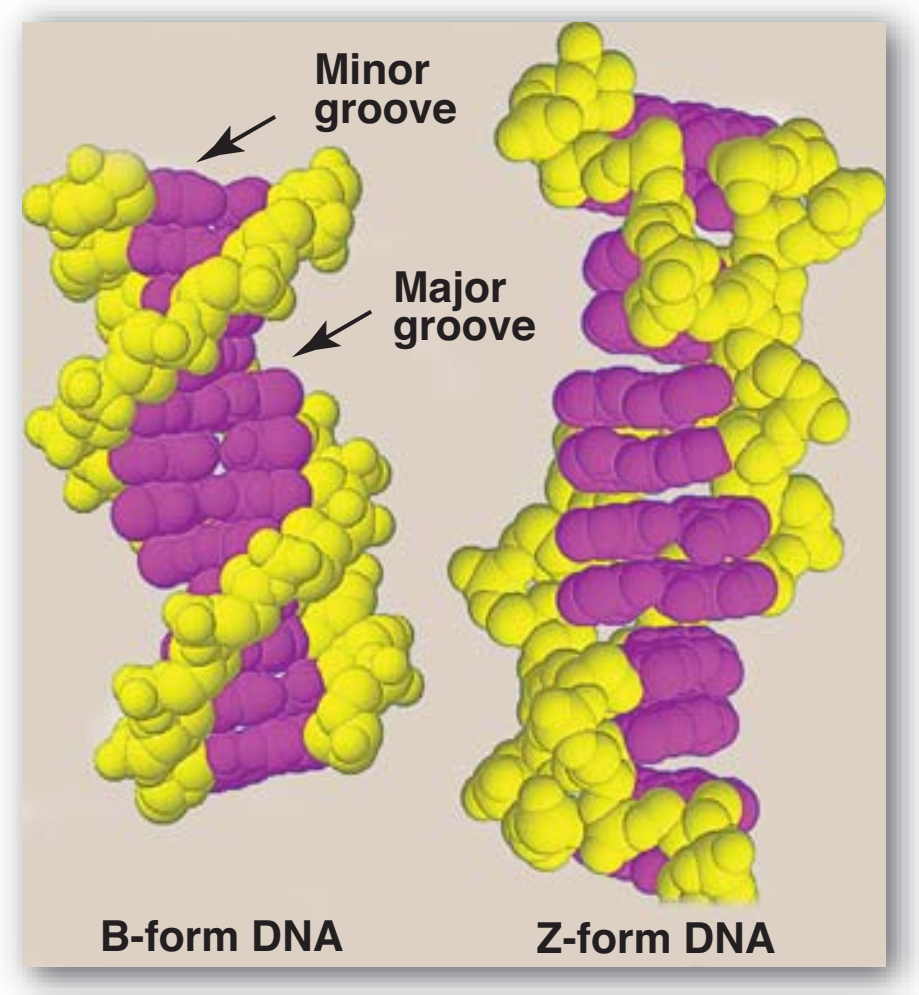
Figür 29.7
B-DNA ve Z-DNA yapıları. |
Figure 29.7
Structures of B-DNA and Z-DNA.
|
|
|
|
|
|
|
| |
3. Çifte sarmalın yapısal biçimleri: DNAnın üç yapısal biçimi vardır: Watson ve Crick tarafından 1953'te betimlenen B biçimi, A biçimi, ve Z biçimi. B biçimi sarmalın her 360° dönüşü için on artık ile, ve baz düzlemlerinin sarmal eksenine dikey olması ile, sağa-dönen sarmaldır. Kromozomal DNAnın birincil olarak B-DNAdan oluştuğu düşünülür (Figür 29.7 B-DNAnın uzay-dolduran bir modelini örneklendirir). A biçimi B biçiminin ılımlı olarak dehidrate edilmesi ile üretilir. O da sağa-dönen sarmaldır, ama her dönüş için 11 baz çifti vardır, ve baz çiftlerinin düzlemleri sarmal eksenine dikeyden 20° uzağa eğiktir. DNA—RNA hibridlerde ya da RNA—RNA çift-telli bölgelerde bulunan uygunluk büyük olasılıkla A biçimine çok yakındır. Z-DNA sola-dönen sarmaldır ve her dönüşte 12 kadar baz çifti kapsar (bkz. Figür 29.7). [Not: Deoksiriboz “zigzag yapar“ ve “Z”-DNA adı buradan gelir.] Z-DNA kesimler DNAnın değişimli pürin ve pyrimidin dizilerinin olduğu bölgelerinde doğallıkla ortaya çıkar, örneğin poli GC. DNAnın B ve Z sarmal biçimleri arasında geçişler gen anlatımının düzenlemesinde rol oynuyor olabilir. |
|
|
| 3. Structural forms of the double helix: There are three major structural forms of DNA: the B form, described by Watson and Crick in
1953, the A form, and the Z form. The B form is a right-handed
helix with ten residues per 360° turn of the helix, and with the
planes of the bases perpendicular to the helical axis.
Chromosomal DNA is thought to consist primarily of B-DNA
(Figure 29.7 illustrates a space-filling model of B-DNA). The A
form is produced by moderately dehydrating the B form. It is also
a right-handed helix, but there are 11 base pairs per turn, and the
planes of the base pairs are tilted 20° away from the perpendicular to the helical axis. The conformation found in DNA–RNA
hybrids or RNA–RNA double-stranded regions is probably very
close to the A form. Z-DNA is a left-handed helix that contains
about 12 base pairs per turn (see Figure 29.7). [Note: The
deoxyribose–phosphate backbone “zigzags,” hence, the name
“Z”-DNA.] Stretches of Z-DNA can occur naturally in regions of
DNA that have a sequence of alternating purines and pyrimidines,
for example, poly GC. Transitions between the B and Z helical
forms of DNA may play a role in regulating gene expression. |
|
|
| |
C. Doğrusal ve dairesel DNA molekülleri
Bir ökaryotun çekirdeğindeki her bir kromozom tek bir uzun, doğrusal dsDNA molekülü kapsar ve bu kromatin oluşturmak üzere proteinler karışımından (histon ve histon-olmayan) oluşan bir karmaşaya bağlıdır. Ökaryotlar, bitki kloroplastları gibi, mitokondrilerinde kapalı, dairesel DNA molekülleri kapsar. Prokaryotik bir örgenlik tipik olarak tekil, çift-telli, süper-büklümlü, dairesel bir kromozom kapsar. Her bir prokaryotik kromozom DNAyı bir nükleoid oluşturmak üzere yoğunlaştırabilen histon-olmayan proteinler ile birliktedir. Ek olarak, bakteri türlerinin çoğu da plasmidler denilen küçük, dairesel, ektra-kromozomal DNA molekülleri kapsar. Plasmid DNA genetik bilgi taşır, ve kromozomal bölünme ile senkronize olabilen ya da olmayabilen eşlemlemeye uğrar. |
|
|
C. Linear and circular DNA molecules
Each chromosome in the nucleus of a eukaryote contains one long,
linear molecule of dsDNA, which is bound to a complex mixture of
proteins (histone and non-histone, see p. 409) to form chromatin.
Eukaryotes have closed, circular DNA molecules in their mitochondria, as do plant chloroplasts. A prokaryotic organism typically contains a single, double-stranded, supercoiled, circular chromosome.
Each prokaryotic chromosome is associated with non-histone proteins that can condense the DNA to form a nucleoid. In addition,
most species of bacteria also contain small, circular, extrachromosomal DNA molecules called plasmids. Plasmid DNA carries genetic
information, and undergoes replication that may or may not be synchronized to chromosomal division. |
|
|

|
|
|
|

